近日,上海交通大学溥渊未来技术学院脑健康中心兰兆辉博士、广西壮族自治区人民医院陈春霞博士及中山大学药学院邓文斌教授在神经病学领域顶级学术期刊《Annals of Neurology》上联合发表了一项突破性研究“Human-Derived Induced GABAergic Progenitor Cells Improve Cognitive Function in Mice and Inhibit Astrocyte Activation with Anti-Inflammatory Exosomes”。该研究利用人源诱导的GABA前体细胞(hiMGEs)在阿尔茨海默病(AD)模型小鼠中取得了显著成果,不仅改善了小鼠的认知功能,还通过抗炎性外泌体抑制了星形胶质细胞的活化。
AD是一种常见的神经退行性疾病,特征是认知功能逐渐丧失。GABA能神经元的损伤被认为是AD病理的一部分。研究团队使用从人类中脑基底区(MGE)衍生的前体细胞(hiMGEs),将其注射到AD模型小鼠的海马齿状回区域。发现1)移植hiMGEs后,小鼠在水迷宫测试和新物体识别测试中的表现显著改善,表明其空间记忆和认知功能得到恢复;2)hiMGEs不仅直接作用于神经元,还通过分泌富含抗炎性miRNA的外泌体发挥作用。这些外泌体能有效抑制星形胶质细胞的活化,减少炎症反应,从而保护神经元;3)研究发现,hiMGEs通过分泌抗炎性外泌体,成功抑制了星形胶质细胞的活化,减轻了炎症反应。移植hiMGEs的小鼠脑内,星形胶质细胞数量显著减少,炎症标志物表达水平也显著降低;4)移植的hiMGEs能够存活、分化并整合到宿主神经网络中,恢复了部分GABA能神经元的功能,从而改善认知功能;5)抗炎性外泌体作用机制:hiMGEs分泌的外泌体富含抗炎性miRNA,这些miRNA通过调节CD4+ Th1细胞介导的肿瘤坏死因子(TNF)通路,抑制了星形胶质细胞的活化(如图1)。
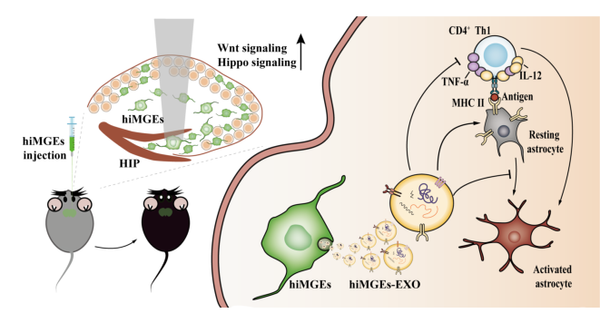
图1
示意图显示了hiMGEs对APP/PS1小鼠认知功能的影响。hiMGEs被注射到海马齿状回区域。hiMGEs在APP/PS1小鼠体内迁移并修复受损的神经元。此外,hiMGEs分泌的外泌体通过调节CD4+ T细胞介导的TNF信号通路,直接或间接地抑制了星形胶质细胞的活化,从而为移植的hiMGEs的生长创造了有利的微环境。
这项研究展示了人源诱导的GABA前体细胞在神经退行性疾病治疗中的巨大潜力。通过改善认知功能和抑制炎症反应,hiMGEs为AD等疾病的治疗提供了新的思路和方法。尽管取得了显著成果,但仍需进一步研究以确认其在人类中的安全性和有效性。未来,研究团队计划进行更多的临床前和临床试验,以推动这一新型治疗方法的应用。这项研究为AD等神经退行性疾病的治疗开辟了新的可能性,有望为患者带来新的希望。

兰兆辉
溥渊未来技术学院助理研究员,硕士生导师。主要从事神经退行性发病机制及记忆储存机制的研究,以第一及共一作者身份在Ann. Neuro.(2024),Cell Rep.(2022),Transl. Res.(2023),Gen. Comp. Endocrinol.(2021)等杂志发表论文十余篇。上海交通大学溥渊未来技术脑健康中心融合和研发人工智能、脑机接口、脑调控、心理学、神经科学等先进技术,探索脑功能和脑疾病的机制,促进脑健康与脑技术的发展。







